为啥是这34个品种?首批鼓励仿制药目录独家深度解析(下)
今天,小编将剩下17个品种的下篇奉上,看在小编周末还在努力加班的份上,还请各位看官加个鸡腿哈~
硫唑嘌呤是嘌呤类似物的免疫抑制剂。它可以用于预防的排斥,还有一系列的自体免疫性疾病,包括类风湿性关节炎、天疱疮、发炎性肠病,像是克隆氏症和溃疡性结肠炎、多发性硬化症 、自体免抑性肝炎、过敏性皮肤炎、重症肌无力和其他相关疾病。
根据新药研发监测数据库(CPM)显示,目前国内硫唑嘌呤国产和进口均有产品上市,其中国产有4家,进口1家。
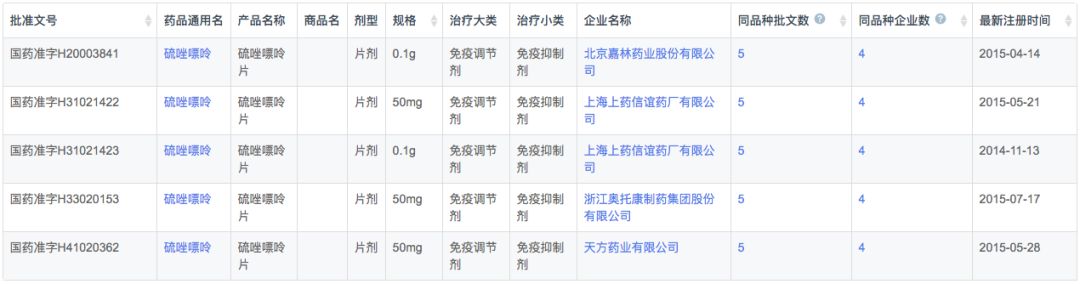

在注册申报中,硫唑嘌呤本土企业和外资企业申报数量接近,但国内在剂型上稍有创新,河北国金药业申报了分散片2类新药的临床申请。
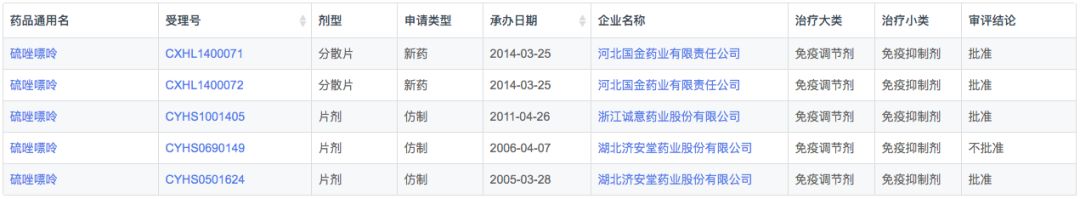
药物综合数据库(PDB)显示,在全球市场中硫唑嘌呤市场波动较大,2015年达到销售高峰2.1亿美元后就开始了下降。
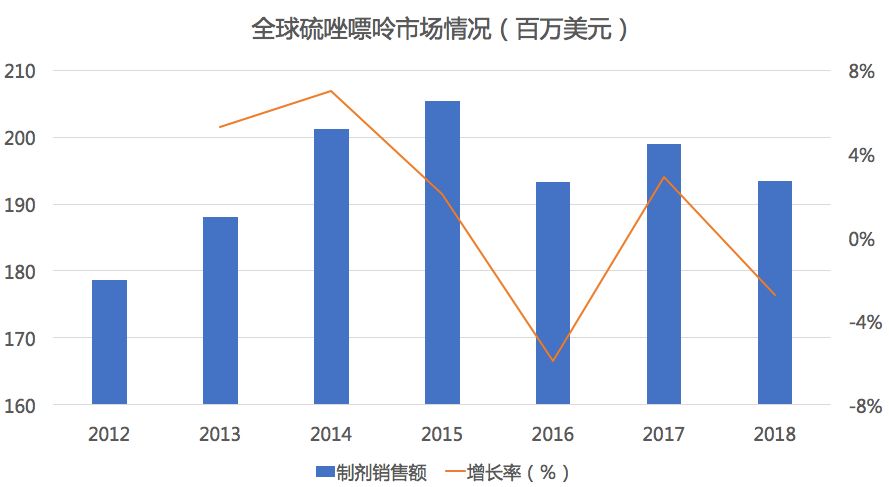
雷洛昔芬由礼来研发,1997年获FDA批准。是一种用于预防和治疗绝经后妇女和糖皮质激素患者骨质疏松症的药物。还用于降低高风险人群患乳腺癌的风险。
根据新药研发监测数据库(CPM)显示,目前国内雷洛昔芬国产和进口均有产品上市,其中国产1家(恒瑞),进口1家(礼来)。

在注册申报中,雷洛昔芬主要为本土企业的仿制药申报,其中除片剂外还新增了胶囊剂,并且也有多年没有企业进行新的注册申报。

药物综合数据库(PDB)显示,在全球市场中雷洛昔芬市场规模逐渐减少,近年复合萎缩率25.2%,2018年销售额仅2亿美元,不到2012年的1/5。

左甲状腺素钠是左旋甲状腺素的钠盐,用于患有甲状腺疾患的患者的激素替代治疗。右旋甲状腺素曾被作为抗胆固醇药物进行研究。但因为对心脏的副作用而被取消。
根据新药研发监测数据库(CPM)显示,目前国内左甲状腺素钠国产和进口均有产品上市,其中国产2家,进口2家。
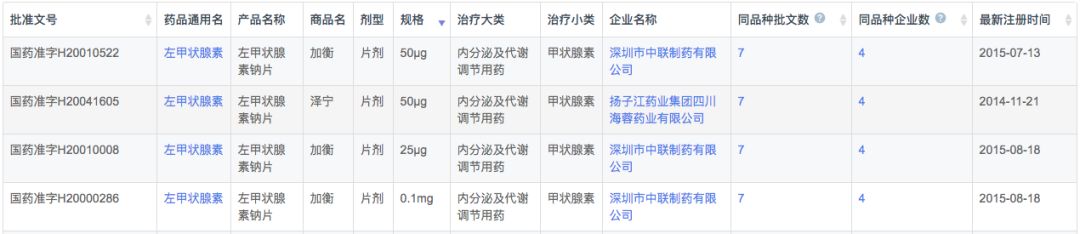
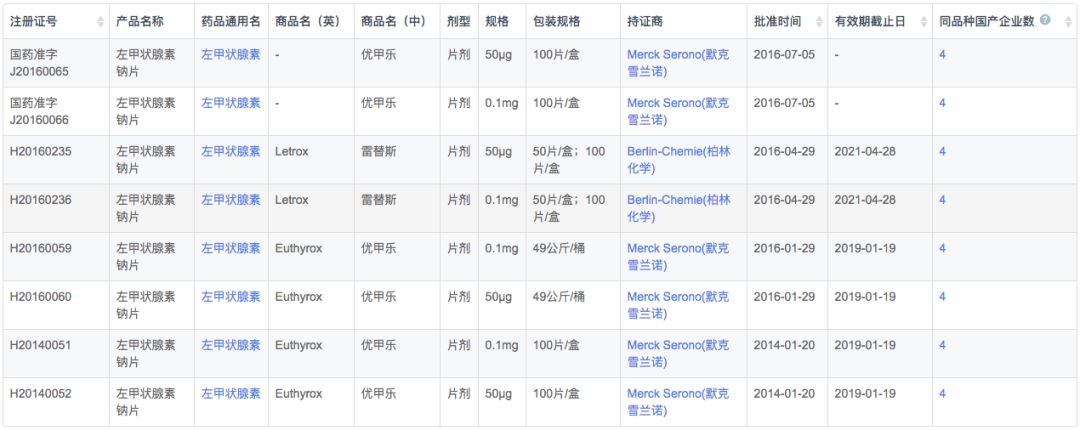
在注册申报中,左甲状腺素钠主要被国外企业占据(54条受理号),而本土企业仅有9条受理信息,涉及扬子江、中联制药、赫素制药以及江苏通用药业4家企业。
药物综合数据库(PDB)显示,在全球市场中左甲状腺素市场规模持续增长,但增长率逐渐下滑,预计40亿即为其销售峰值。

依来曲普坦由辉瑞研发,2001年1月欧盟首次批准上市,2002年12月被美国FDA批准上市,适用于偏头痛。亲脂性强,能透过血脑屏障。通过激活5-HT1相关受体来抑制神经肽的释放,收缩颅内血管并抑制神经性炎症来发挥抗偏头痛效应。
根据新药研发监测数据库(CPM)显示,目前国内依来曲普坦既无国产也无进口产品获批上市,仅有济南久创化学有限责任公司1家的新药临床申请获批。

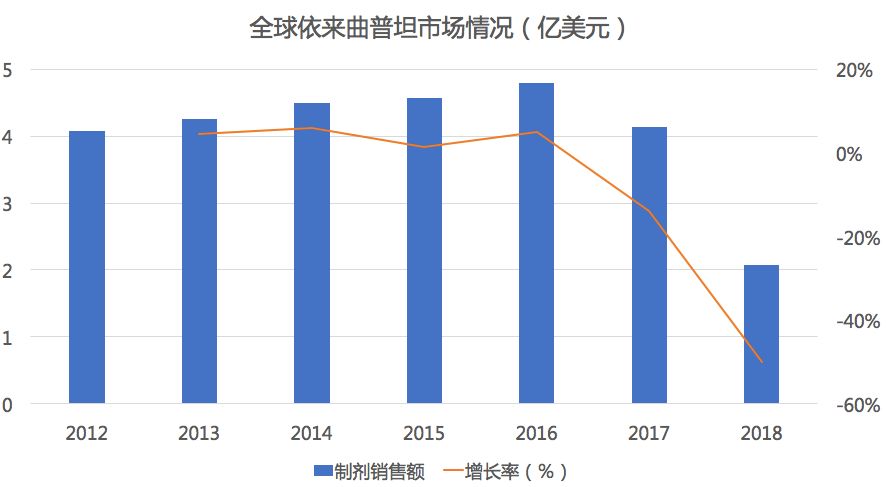
药物综合数据库(PDB)显示,在全球市场中依来曲普坦市场规模自2013-2016保持了4年的0增长后出现大幅度下滑,2018年市场萎缩50%。
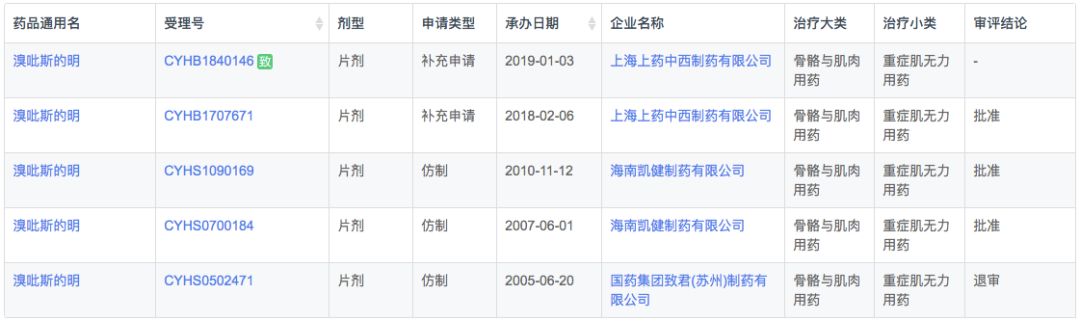
溴吡斯的明是一种用于治疗重症肌无力、手术后腹胀气、尿潴留、室上型心动过速等的药物。它还与阿托品一起使用以终止非去极化类型的神经肌肉阻滞。在我国大部分地区溴吡斯的明是重症肌无力的唯一用药,但是由于价格低廉,企业生产积极性小,也曾出现多次短缺。
根据新药研发监测数据库(CPM)显示,目前国内溴吡斯的明仅有3家国产普通速释片剂上市,无缓释剂型及进口品种上市。

在注册申报中,溴吡斯的明主要为本土企业的仿制药申报,其中CDE在2019年1月3日受理了上海上药中西制药有限公司的一致性评价申请,加上鼓励仿制的扶持政策,预计将会快获批上市。
药物综合数据库(PDB)显示,在全球市场中溴吡斯的明市场规模降中有升,2018年销售1.3亿美元。

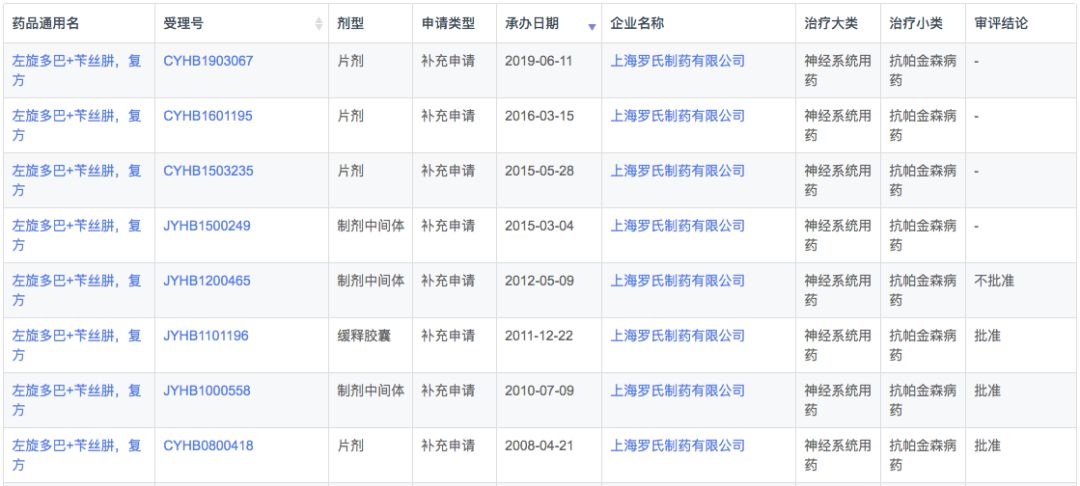
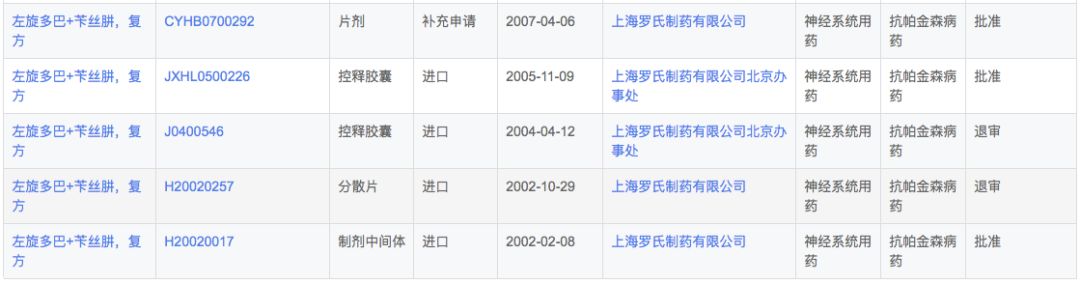
多巴丝肼由SkyePharma研发,由左旋多巴和周围脱羧酶抑制剂苄丝肼组成。苄丝肼抑制左旋多巴在脑外的脱羧作用,提高左旋多巴脑内有效浓度。适用于帕金森病、症状性帕金森综合症(脑炎后、动脉硬化性或中毒性),但不包括药物引起的帕金森综合症。
根据新药研发监测数据库(CPM)显示,目前国内多巴丝肼有片剂和胶囊两种剂型上市,其中片剂只有罗氏1家,而本土企业全部为胶囊剂型。
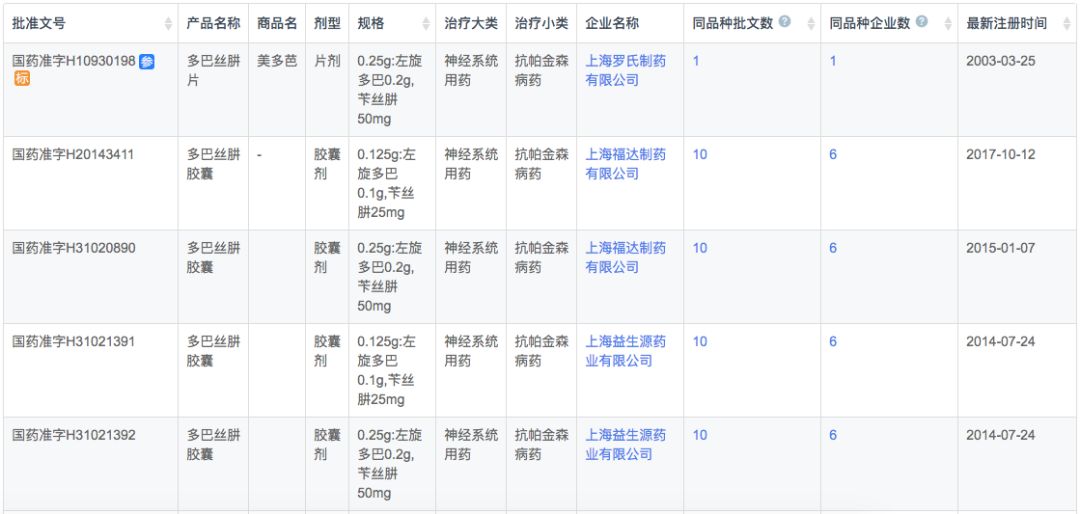
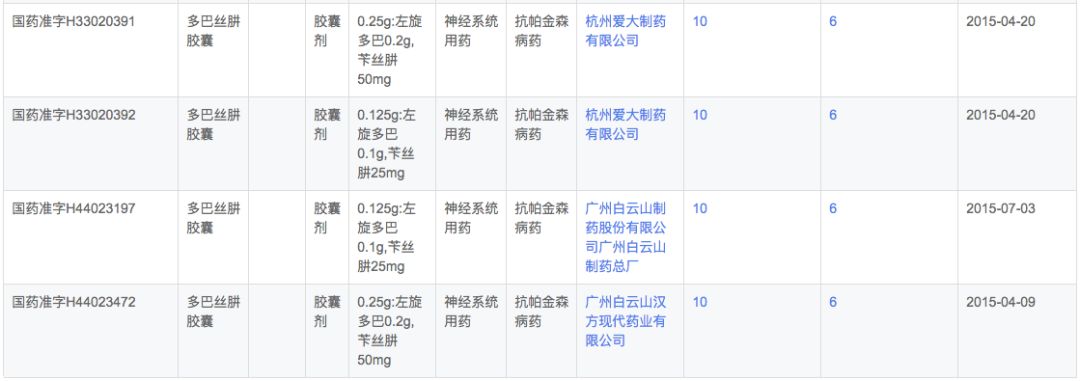
在注册申报中,多巴丝肼除了已经获批上市的上海福达递交了1次补充申请外,其余注册申报企业全部都为罗氏,可以发现罗氏已经从普通常释片剂和胶囊剂逐步发展出了缓释和分散剂型,并且控制了上游中间体产品。
布瓦西坦由UCB研制,是抗癫药左乙拉西坦吡咯烷烃的4位碳原子连接正丙基的类似物。EMA和FDA分别于2016年1月和2016年2月批准用于治疗16岁及以上部分性发作型的癫患者,伴或不伴随继发全身性发作的辅助治疗药。
根据新药研发监测数据库(CPM)显示,目前国内布瓦西坦既无国产产品也无进口产品上市,国内最高研发状态为原研UCB的临床申报。

药物综合数据库(PDB)显示,在全球市场中布瓦西坦自上市以来市场规模不断扩大,2018年销售金额近2亿美元。

福沙吡坦由默克研发,为阿瑞匹坦的磷酸酯前药。是一种肿瘤辅助用药,用于肿瘤治疗过程中,化疗的辅助用药,防止化疗引起的恶心、呕吐。2008年1月获美国FDA批准上市,同年1月11日获EMA批准。
根据新药研发监测数据库(CPM)显示,目前国内福沙吡坦既无国产产品也无进口产品上市,国内最高研发状态为仿制药上市申请,涉及齐鲁、豪森、正大天晴等20多家企业,其中正大天晴/润众为优先审评品种,而原研默克自2014年获批临床后再无动静。
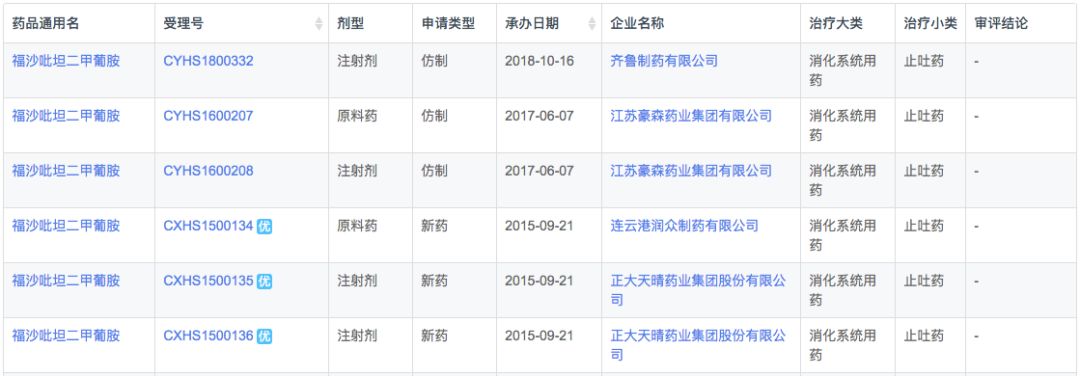
药物综合数据库(PDB)显示,在全球市场中福沙吡坦二甲葡胺市场规模较为平稳,2018年销售3.6亿美元。
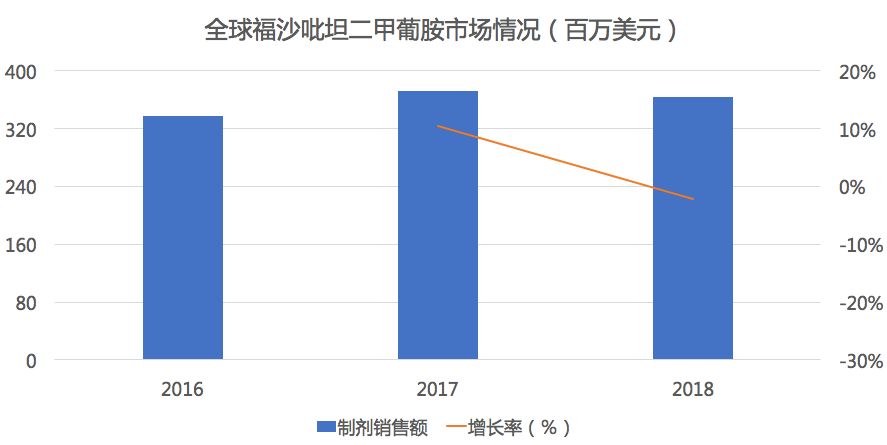
曲前列尼尔曾经的我国“药王”,曾在2016年以99900元/支的身价高居药价榜首,由UNITED Therapeutics研发的一款人工合成前列环素药品,可以促进血管舒张,同时可抑制血小板的聚集,用于肺动脉高压的症状治疗。该药物最早于2002年5月21日获FDA批准。曲前列尼尔半衰期长、药物结构稳定、使用方便,作为一线治疗和抢救药物应用广泛。
根据新药研发监测数据库(CPM)显示,目前国内曲前列尼尔无国产产品上市,仅有原研UNITED Therapeutics,但原研产品的上市许可证在2019年5月2日已经到期,也没有新的上市许可证申请及通过,难道原研已经放弃了中国市场?或者是由于专利将近已开发出同品种的其他剂型来回避专利问题?亦或者转移给了还在注册申报的合作伙伴兆科药业?
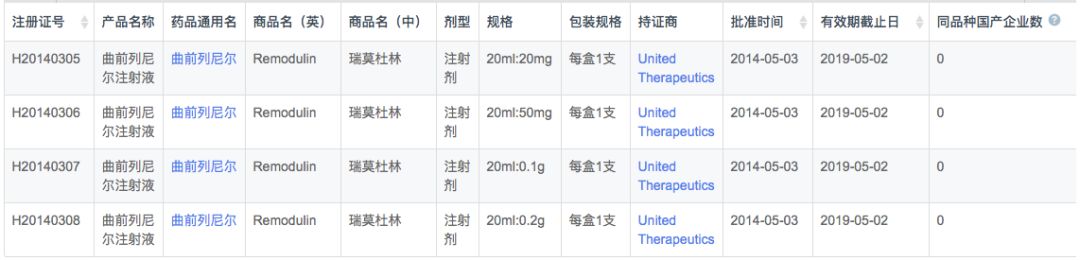
在注册申报中,国外企业曲前列尼尔的申报数量最多(25条受理号),其中礼来主要开展的是联合用药研究(赖脯胰岛素+枸橼酸+曲前列尼尔),而原研已经发展出了口服缓释片(国家重大专项);国内企业仅有兆科药业1家企业开展研究,并申报了上市申请。

值得一提的是原研曲前列尼尔最早于2011年9月由兆科药业、UNITED Therapeutics和巴斯特制药联合申报,作为进口新药申请临床,但审批结论是“批准进口”(可能是豁免临床)。
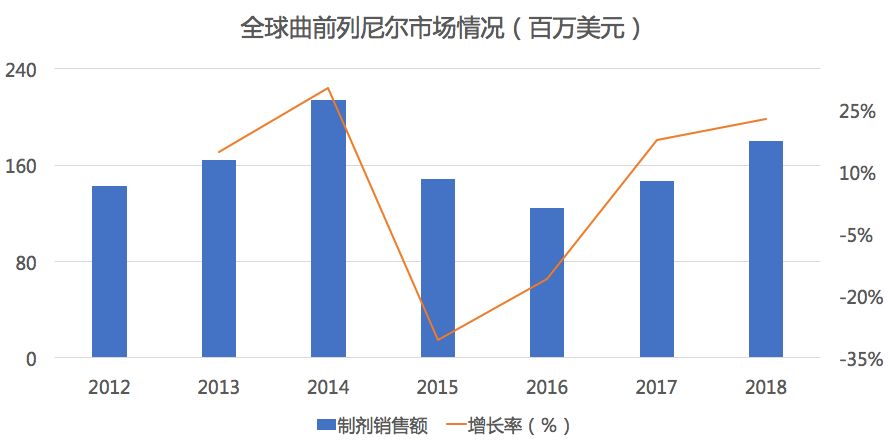
药物综合数据库(PDB)显示,在全球市场中曲前列尼尔自2014年销售额达到峰值2.1亿美元后逐渐下滑,但在2017年后重新出现了正增长。
波生坦由由瑞士Actelion研发,2001年11月首次被美国FDA批准用于治疗肺动脉高压。自上市后一度居肺动脉高压用药市场之首。可降低肺和全身血管阻力,从而在不增加心率的情况下增加心脏输出量,改善特发性肺动脉高压患者的运动能力和血流动力学指标。2006年10月批准进入国内。
根据新药研发监测数据库(CPM)显示,目前国内波生坦无国产产品上市,仅有原研Actelion,并同时拥有制剂与原料药生产许可。
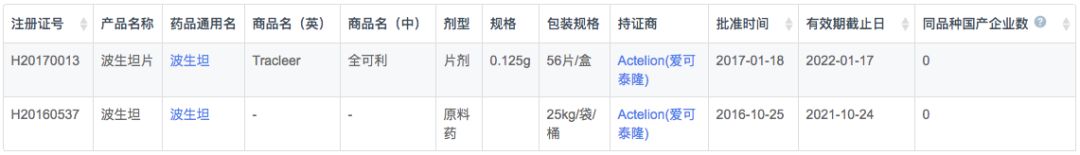
在注册申报中,国内外企业波生坦申报数量相当(21v.s.27),但CDE已经受理来原研Actelion分散片剂型的上市申请,并且为特殊审批和优先审评品种。
药物综合数据库(PDB)显示,在全球市场中波生坦市场规模自2014年开始逐渐萎缩,2018年销售5.3亿美元。

盐酸考来维仑由Gel Tex Pharmaceuticals研发,是一种非吸收性聚合物类降脂药物。它可与肠道中的胆汁酸结合并显著减少后者的再吸收,用于运动和饮食治疗法的辅助疗法,单用或再并用一种他汀类药物可降低原发性高血胆固醇症患者的高水平低密度脂蛋白胆固醇。2000年5月获美国FDA批准上市。
根据新药研发监测数据库(CPM)显示,目前国内盐酸考来维仑既无国产也无进口产品上市,国内最高研发状态也仅为申报临床,剂型以干混悬剂为主(石药、罗欣等8家企业),而片剂只有泰德等5家企业申报。

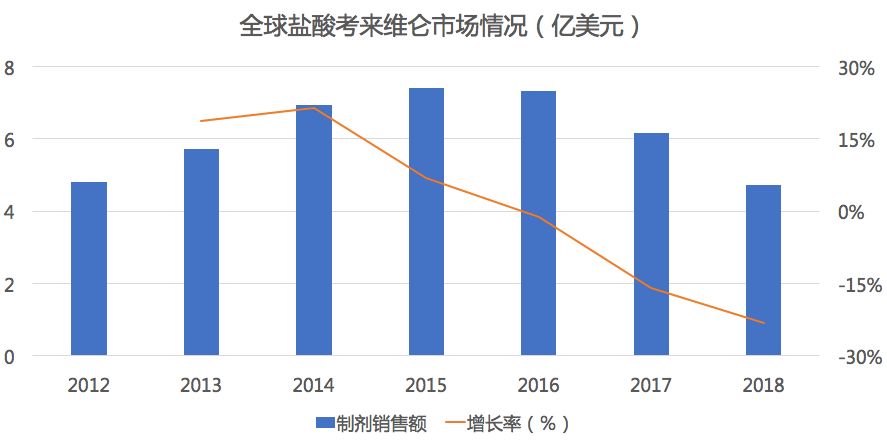
药物综合数据库(PDB)显示,在全球市场中盐酸考来维仑市场自2015年达到7.4亿美元后就开始了逐年下滑。
多非利特为辉瑞开发的针对心房颤动的口服抗心律失常药,具有较高的逆转为窦性心律的作用,2000年5月在美国首次上市,为第III类抗心律失常药物。
根据新药研发监测数据库(CPM)显示,目前国内多非利特既无国产也无进口产品上市,国内最高研发状态也仅为申报临床,并且都是在2005年以前进行申报的,无外资企业注册申报,申报剂型以胶囊为主,也有片剂剂型的临床申报。
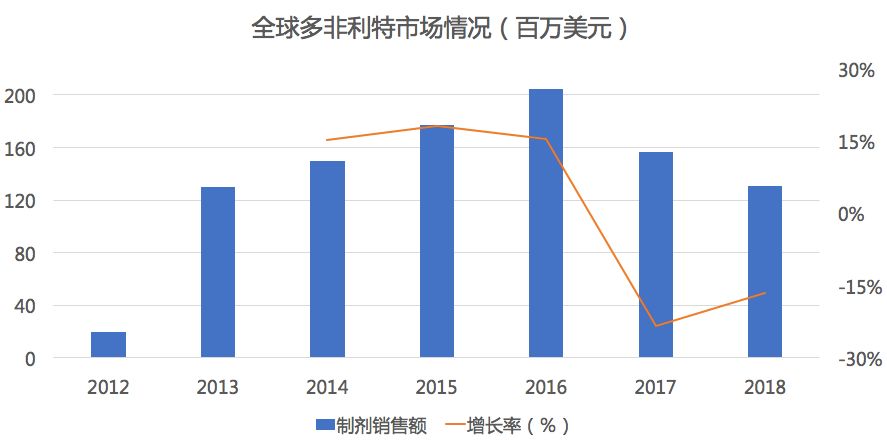
药物综合数据库(PDB)显示,在全球市场中多非利特2016年达到2亿美元的峰值后便出现了大幅度下滑,2018年缩水了仅40%。
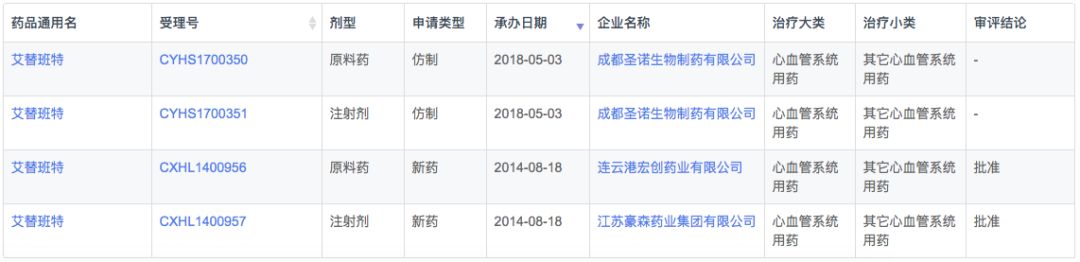
艾替班特是由Jerini AG研发的特异性的肽模性缓激肽B2受体拮抗剂。2011年8月25日获美国FDA批准上市,用于治疗年龄≥18岁成人的一种罕见疾病——遗传性血管性水肿的急性发作。
根据新药研发监测数据库(CPM)显示,目前国内艾替班特既无国产也无进口产品上市,国内最高研发状态为成都圣诺生物的申报上市,另外豪森也通过了临床申请。
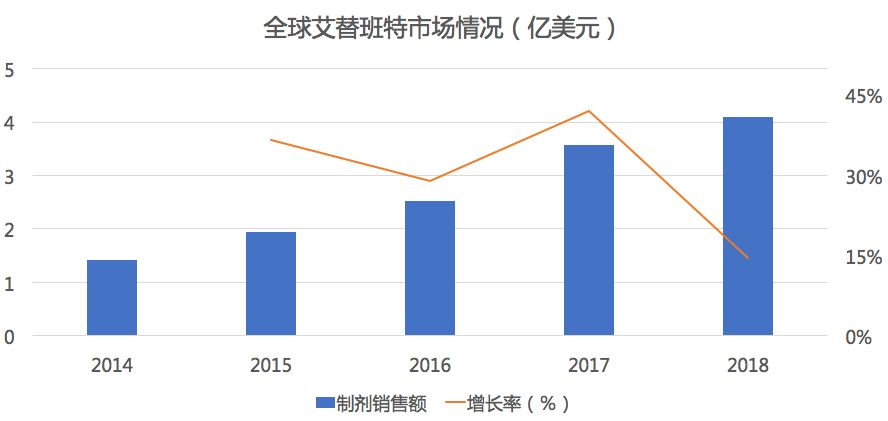
药物综合数据库(PDB)显示,在全球市场中艾替班特市场规模持续增长,复合增长率超过30%,2018年市场销售4.1亿美元。
是由诺华研发的铁螯合剂产品,其主要用途是减少因β-地中海贫血和其他慢性贫血等疾病而接受长期输血的患者的慢性铁超负荷。于2005年11月获美国FDA批准,是FDA批准的第一个能够常规使用的口服驱铁剂,获准在≥2岁、输血造成的慢性铁负荷过多的患者中使用,在欧洲它被推荐作为6岁以上地中海贫血铁过载患者的一线用药。
根据新药研发监测数据库(CPM)显示,目前国内地拉罗司仅原研诺华在2010年6月获批上市,在2015年换证后上市许可延长至2020年。
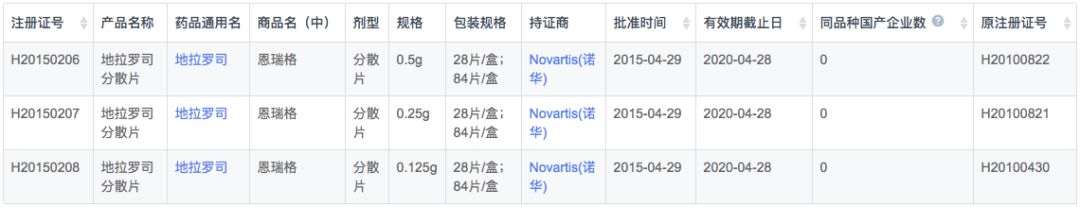
在注册申报中,国内地拉罗司进口申报数量远大于本土企业(76v.s.7),剂型以分散片为主,但诺华也申报了普通片剂。本土企业全部为仿制药上市申报,包括奥赛康、豪森和康辰药业3家企业。
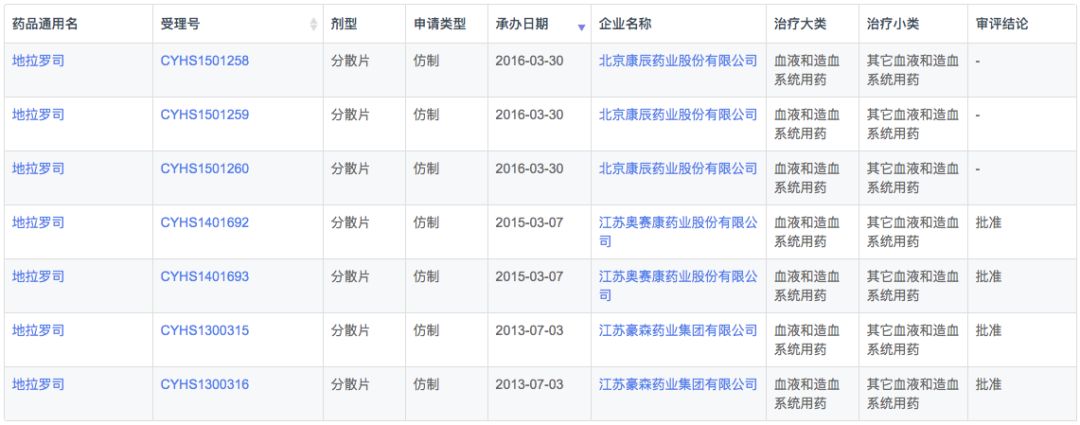
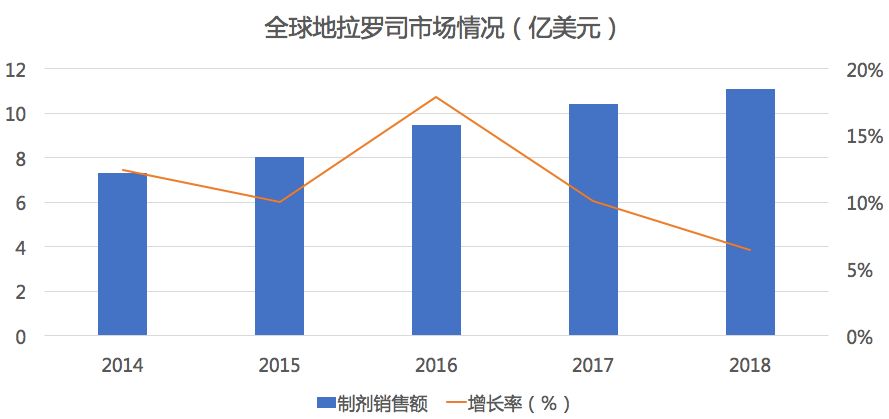
药物综合数据库(PDB)显示,在全球市场中地拉罗司市场规模增长较快,2018年市场销售11.1亿美元。
阿卡他定是由Allergan研发的一种用于预防过敏性结膜炎患者眼痒的药物,2010年7月获得FDA上市批准。该药为滴眼液, 用于2岁以上人群过敏性结膜炎相关性眼部瘙痒的治疗。阿卡他定属组胺H1-受体拮抗剂和肥大细胞稳定剂,经抑制肥大细胞释放组胺并阻止组胺作用,从而减轻过敏反应。此外,阿卡他定还有降低趋药性、抑制嗜曙红细胞活性作用。
根据新药研发监测数据库(CPM)显示,目前国内阿卡他定既无国产也无进口产品上市,国内最高研发状态为申报临床,包括原研Allergan及华威医药和湖北远大2家本土企业。

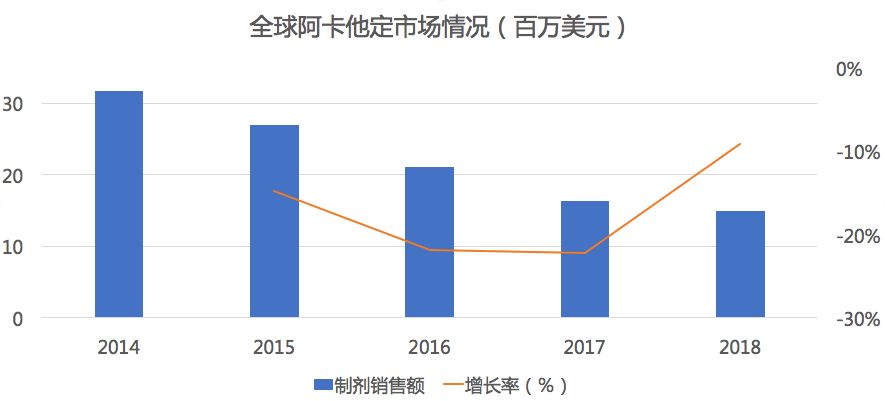
药物综合数据库(PDB)显示,在全球市场中阿卡他定自2014年一种都为负增长,年平均萎缩15%,2018年市场销售0.15亿美元,已缩水50%以上。
他氟前列素由日本参天制药和默沙东公司联合开发,是一种前列腺素类似物,作为局部用药来控制青光眼缓解高眼压。2008年5月首次在德国上市,随后陆续在澳洲、拉丁美洲、欧洲上市,2012年2月获FDA批准。
根据新药研发监测数据库(CPM)显示,目前国内他氟前列素无国产产品上市,仅有原研参天制药的3个规格/包装上市。
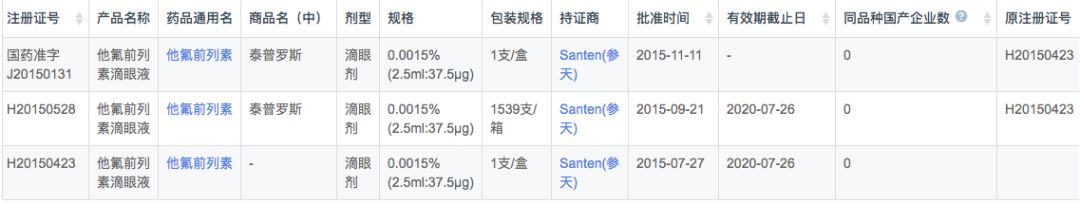
在注册申报中,国内他氟前列素主要为原研参天制药申报(8条注册受理),而本土企业最高研发状态仅为申报临床,包括四川科伦和盛迪医药2家企业。
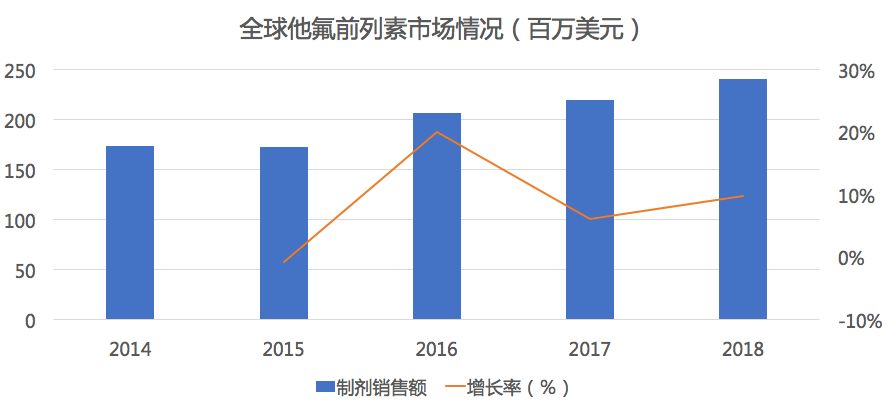
药物综合数据库(PDB)显示,在全球市场中他氟前列素市场规模一直保持在10%左右的增速,2018年市场销售2.4亿美元。
氨己烯酸由Marion Merrell Dow开发,并进一步由Ovation Pharmaceuticals完善,2009年灵北制药以9亿美元价格收购Ovation后,向美国FDA提出申请,同年8月获批作为一种辅助治疗用于治疗难治性癫痫、复杂的部分癫痫发作、继发性全身癫痫发作,以及用于治疗韦斯特综合征婴儿痉挛的单一疗法。
根据新药研发监测数据库(CPM)显示,目前国内氨己烯酸既无国产也无进口产品上市,国内最高研发状态为远大医药的申报上市,已以“罕见病”为由纳入优先审评,将迎来国内首仿上市。

药物综合数据库(PDB)显示,在全球市场中氨己烯酸2017年达到销售高峰5.2亿美元后,2018年市场规模降低了12%。
